「免疫学と共に40年」 —大阪大学医学部学友会総会特別講演(2012年5月26日)より、一部改変 (2012年10月6日)
1)人類の歴史と感染症
医学の歴史上おける重要な発見は数々があります。18世紀末のワクチンの発見、19世紀の病原微生物の発見、そして20世紀初頭のペニシリン等の抗生物質の発見の3つは、感染症の制御ということで歴史を刻みました。現在の人類の直接の祖先であるホモ・サピエンスの誕生は今から20万年前と考えられています。我々はその歴史の中で感染症には常に悩まされてきました。「人類の歴史は感染症との戦いであった」と言っても過言ではないぐらいです。
紀元前5世紀に、カルタゴ軍とシラクサ、今のギリシャですが、戦いをした物語が残っています。このシチリア戦争(カルタゴとギリシャの戦い)の勝敗は、最終的に“免疫”が決めました。カルタゴ軍とシラクサ軍は戦争をし、盛んに戦ったわけですが、戦争途中で黒死病、ペストが流行して戦争が出来なくなりました。8年後にもう一度戦争をしたのですが、その8年の間に、カルタゴは国が栄えて富み、一方シラクサは経済が疲弊しました。カルタゴは富に任せて屈強な若い外国の傭兵を雇いました。一方、ギリシャは昔の生き残った老兵だけで戦いました。屈強な外国人傭兵を雇ったカルタゴ軍は強力でした。この戦争はカルタゴ軍の大勝利に終わるはずでした。しかし、その途中で再度ペストが発生したのです。若い屈強なカルタゴ軍はペストに罹患し倒れていきました。一方の老兵を抱えたシラクサ軍は、8年前のペストの生き残りの人ばかりですから、免疫があってペストに罹患しなかったのです。その結果、カルタゴ軍は大敗しました。このように、当時、感染症あるいは免疫応答が戦争の勝敗を決定したことが度々あったのです。
ペスト以外の感染症もたくさん有り人類に大きな影響を与えてきました。人の平均寿命は30~40歳をなかなか越えることができませんでしが、この100年の間に平均寿命は約80歳になっています。様々な要因がありますが、感染症の克服は一つの要因と考えられています。1796年に予防注射が発見されました。イギリスのジェンナーが、人に牛の天然痘(牛痘)を植えることによって天然痘に罹患しない、あるいは罹患しても軽症で済むという現象を発見したのです。1838年に大阪大学の原点である適塾を開設した緖方洪庵は、1849年に天然痘の予防注射のための除痘館を設立しました。この除痘館は、1858年に日本で最初の幕府公認の種痘所となりました。このような努力によって予防注射発見から200年後の1979年に、世界保健機構による天然痘撲滅宣言が出されました。まさにこれは人類の歴史において画期的な出来事です。1つの病気が人為的な免疫の誘導によって地球上から消えてしまったのです。
2)自己免疫疾患———人類の生存に必要な免疫が引き起こす病気
免疫は私たちが生きて行くために重要です。私たちのまわりには様々な感染症を引き起こす微生物がたくさんいます.免疫が無かったら我々はこの環境で生きていくことができません。一方で、自己免疫疾患という病気があります。これは、関節リウマチ、全身性エリテマトーデス、Ⅰ型糖尿病、甲状腺炎、多発性硬化症など、いわゆる難病と言われる病気です。自己免疫疾患は全人口の5%ぐらいに発症が認められます。有名な画家のルノワールも晩年関節リウマチに罹患し車椅子生活を送りながら痛みと戦い絵を描き続けました。様々な遺伝的要因やいろいろな環境要因によって起こるので、何が原因ということは明確ではありませんが、様々な遺伝的要因と環境要因が相互作用して年齢を重ねると共に発症する厄介な病気です。自己免疫疾患とは、免疫系が自己の臓器を破壊することによって生じる病気です。免疫がなければ我々はこの世の中に生きていけないのですが、それがひとたび自分の体に向けられると、恐ろしい病気になるわけです。では、自己免疫疾患はどうやって起こるのでしょうか。
3)免疫応答
まず、免疫応答はどのように起こるのか考えてみましょう。我々の体の中には扁桃腺やリンパ節や胸腺、脾臓、あるいは虫垂、骨髄などの免疫臓器があります。骨髄や胸腺等の一次免疫臓器でリンパ球などの免疫細胞が造られます。造られたリンパ球はリンパ節等の二次免疫臓器に移動し、そこで免疫応答が起こります。リンパ節の中にはBリンパ球やTリンパ球が存在しています。さらに、抗原をリンパ球に提供する樹状細胞も存在しています。樹状細胞は、2011年ノーベル医学・生理学賞を授与されたアメリカのスタインマン博士が発見した重要な細胞です。すなわち、細菌やウイルス、花粉などが体の中に入ってくると、体の中で樹状細胞によってこれら抗原がリンパ球に提供され、Tリンパ球、Bリンパ球等の免疫担当細胞がお互いに情報交換をし、協力しながら免疫応答を起こします。 その結果、抗原に特異的な抗体、あるいはキラーT細胞が造られます。感染防御反応以外にも、アレルギー反応や臓器移植における拒絶反応のような様々な種類の免疫応答が起こります。しかし、一歩間違えば、自分の体に対して免疫応答が起こることによって、自己免疫疾患が起こります。
4)インターロイキン:免疫応答に重要な役割を果たすサイトカイン
免疫細胞間の情報交換に関与している物質が、現在サイトカインと呼ばれている液性因子です。サイトカインという物質の中には、インターロイキンと呼ばれている一群の因子もありますし、インターフェロンと呼ばれている群もあります。TNF(Tumor Necrosis Factor)、エリスロポエチン、G-CSFなどと呼ばれている物もありますが、これらはすべてサイトカインの仲間です。インターロイキンと呼ばれている因子だけでも現在30種類以上あります。さらに、EGFや増殖因子等も広義のサイトカインと考えられていますので、これらを加えれば60種類以上のサイトカインの仲間があります。これらが免疫細胞間の情報交換に関与して、さまざまな免疫応答を起こします。
現在ではエリスロポエチンやインターフェロンのようにサイトカインそのものが治療薬として実際に臨床の場で使われています。それ以外にも、これらの阻害剤、たとえばIL-1とかTNFの阻害剤、あるいは、IL-6の阻害剤があります。これらは既に炎症性疾患や関節リウマチ等の自己免疫疾患等の患者さんの治療に使用されており、有効な効果が認められています。
5)インターロイキン6の発見———目の前の山を登りきる
私は、1986年にIL-6を発見したということで、岸本忠三先生と、IL-1の発見者のディナレロ(米国コロラド大学教授)と、3人共同で2009年にスウェーデンの王立科学アカデミーから クラフォード賞 をいただきました。その時にカロリンスカ研究所のノーベル講堂とルンド大学の講義室で講演をしました。演題は、「 How extensive the view from a mountain top is! ---A story of interleukin 6」ということで、山の頂上、はるか彼方の山の頂上に登れば一体何が見えるだろうか? そういう問い掛けでした。———頂上に登ってみないとその頂上の景色はわからないだろう。目の前の山を登りきることが非常に重要である。頂上に辿りつく前に、途中で下りてしまったら、もう何も見えない。われわれの人生における山でも、頂上まで登りきることが重要である。人生の登山においては、山登りのような道標はない。人生では、困難な時期でも、それが9合目なのか5合目なのかはわからない。とにかく頂上まで登ってみないとわからない。登って初めて新しい景色が見える。そういうことで、「目の前の山を登りきる」ことは大事ですよ、と話をしたわけです。
40年前の1972年に大阪大学医学部を卒業して、すぐに米国に留学しました。当時Tリンパ球、Bリンパ球がいろいろな液性物質を介して、免疫反応が起こる事がわかっていました。Bリンパ球に抗体産生を誘導する物質が存在するであろうし、T リンパ球の増殖を誘導する物質が存在すると考えられていました。当時の免疫学者の大きな興味の一つは、これらの液性因子の本態は何かということでした。今60以上有るサイトカインの実体は不明でした。
私はアメリカから帰国して、結核性胸膜炎の患者さんが多数入院していた大阪府立羽曳野病院に勤務しました。治療では胸水を抜きます。その中にはたくさんのリンパ球があります。普通はそれを捨てますが、私は免疫応答に関与する液性因子の実体は何かという疑問が常に頭にありました。リンパ球を胸水から分離して、結核菌の菌体(ツベルクリン)と一緒に培養して得た培養上清を自分のBリンパ球に加えてみると、抗体産生を強く誘導したのです。結構強い活性があり、1人の患者さんから10億個のリンパ球が採れましたので、精製できるのではないかという期待を抱いて実験を開始しました。その後、尾上薫教授の助教授として熊本大学医学部に赴任し精製の努力を続けました。1984年に、山村雄一先生が設立した大阪大学細胞工学センターの教授に岸本先生が就任されました。岸本先生の助教授として大阪大学に呼んでいただき、1986年に目的の分子の遺伝子を同定する事ができました。
大阪大学蛋白質研究所の綱澤先生の助けを借りて、1984年の年末には目的の分子の部分的なアミノ酸の配列を決めることができました。1985年は私の人生にとっては最高の年になるだろうと、1985年の元旦を希望に胸を膨らませて迎えました。ところが、年が明けてもいいことは全くありませんでした。いくらやっても目的の分子の遺伝子は採れなかったのです。3月には私の父親が肝臓がんで亡くなりましたし、1985年8月12日には、日航のジャンボジェット機が、524人の乗客を乗せて御巣鷹山の尾根に墜落するという痛ましい事件もありました。その時に当時の大阪大学の教授2人も亡くなりましたし、私と一緒に研究をしていた保川君の弟さんも亡くなりました。私にとっては暗い夏でした。年末を迎えて、不整脈で眠れない状況になって、バラ色になるはずだった1985年はどん底の1年間で終わりました。1986年になって気分を一新して、新たに精製からやり直しました。その時は単にN末のアミノ酸配列を決めるのではなく、かなりリスクを伴いますが、精製蛋白をさらに限定分解を行ない、得られたフラグメントのN末端のアミノ酸配列を決めました。これは一歩間違えばすべてを失う大変なリスクを伴う作業でしたが、1985年と同じ事をしても道は開けないという思いが私にこのような選択をする決意を促してくれました。一燈、乃ち己の信念を貫く事の重要性を体験しました。暗夜を、一燈を信じて進むうちに、1986年5月25日日曜日に、突如、視界が開けました。 研究室に行ってオートラジオグラフィーを開けたところ、目的の遺伝子が採れていたのです。頂上というか目指すところというのは、ある日突然、一瞬に現れるわけです。しかしそれは求めている者にしか見えてこない、つまり、もがき続けながらも山を登り続けている者にだけ、突然視界が広がるわけですが、まさにそういう心境でした。
その後、1986年11月6日の『Nature』にこの論文を発表しました。今だったら考えられないことですが、『Nature』に論文を発表してわかったことがありました。同年9月の『Eur.J.Biochemistry』に、26-kDa proteinの遺伝子の配列が載っていました。10月号の『The EMBO Journal』には、インターフェロンβ2の遺伝子の配列が載っていました。私たちはB cell stimulatory factor 2ということで発表したわけですが、それぞれが全部同じものだということがわかりました。みんな名前が違いますし、配列だけの発表ではすぐには同じ物だとは気がつかなかったのです。その後、プラズマサイトーマ/ミエローマ増殖因子や肝細胞刺激因子(肝臓に作用してCRP等の急性期蛋白を誘導する物質)、これらは全て同じ分子だということが明らかになりました。これは、まさに頂上に着いて初めて見える景色の一例です。
そして、1988年12月14日にニューヨーク・アカデミーが主催する国際会議に、これらの生理活性因子を研究していた人たちが集まって、この分子をInterleukin 6 (IL-6)という名前にしようということになりました。これで初めて、「IL-6」という名前が世に誕生しました。
6)山頂から観た景色:IL-6は関節リウマチ等の病気に関与している
その後、IL-6は単にBリンパ球に作用するだけではなくて、破骨細胞を活性化したり肝細胞を刺激したり、さまざまな活性がある多機能なインターロイキンであるということがわかりました(図1)。これを契機に、受容体もわかり、とにかくいろいろなことがわかりました。つまり、頂上に立って観た景色は広大な広がりがありました。
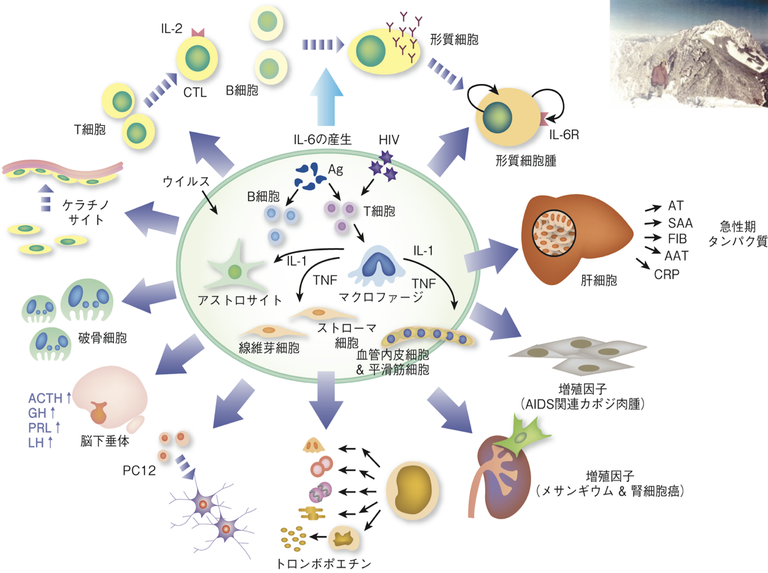
図1: インターロイキン6は様々な機能を有するサイトカインである。
IL-6が病気に関係しているかもしれないというデータも出始めました。心臓粘液腫の患者は自己免疫病特有の臨床症状を呈しますが、腫瘍を摘出するとこれらの症状は消えることが知られていました。我々は粘液種がIL-6を産生している事を見いだし、IL-6が自己免疫疾患の症状に関与している可能性を指摘しました。また、関節リウマチ患者さんの関節液の中にはIL-6がたくさんあるということも見つけました。IL-6が関節リウマチなどの自己免疫疾患に関係ある可能性が考えられました。私としてはわくわくするようなデータでした。
私は1つのモデルを考えました。乃ち、関節のような非免疫組織に、ウイルスや細菌感染、損傷、物理的な刺激などが起こり、そのことが免疫システムと相互作用することによって関節リウマチなどの慢性炎症性疾患が起こる可能性です。引き続きIL-6の受容体に種々の変異を導入して細胞内シグナル伝達機構とIL-6の生理活性との関係などを研究して行きました。その過程で、IL-6の受容体gp130の759番のチロシンをフェニルアラニンに変換した変異gp130を発現するF759マウスでは、IL-6刺激によるSTAT3活性化が非常に高くなることがわかりました。驚いたことに、このマウスは、生後1年ぐらいたつと、自然に関節リウマチによく似た関節炎を発症しました(図2)。
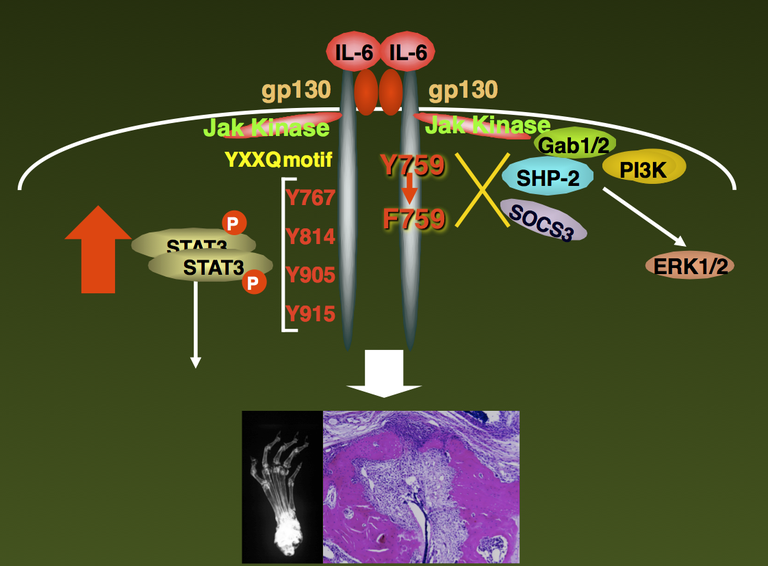
図2: IL-6受容体gp130の759番目のチロシンに変異を有するF759マウスは生後1年位
で関節リウマチに酷似した関節炎を自然発症する。
原因をいろいろ調べていくと、免疫システムと非免疫系の相互作用で起こることが明らかになりました。すなわち、この病気はTリンパ球がないと起こらないのですが、gp130の変異はT リンパ球には不要で、非免疫系の細胞に要ることが明らかになりました。すなわち、非免疫系細胞にIL-6の信号がたくさん入ると、免疫系のTリンパ球の活性化が増強されて起こる自己免疫疾患でした。つまり、この病気は、免疫系と非免疫系が相互作用して起こるものでした。
7)更なる挑戦
さらに、IL-6の産生を増幅するような、私たちは「IL-6アンプ」という名前を付けていますけれども、分子的にはNF-κBとSTAT3が協調してIL-6の産生を増幅する、IL-6増幅回路が非免疫系の細胞に存在するということを見つけました。実際、このIL-6アンプを体からなくしてやると関節炎や多発性硬化症のモデル疾患も起こらなくなりました。現在、われわれは自己免疫疾患の発症に関して4ステップモデルを提唱しています。自己免疫疾患に必要な4つの条件です(図3)。
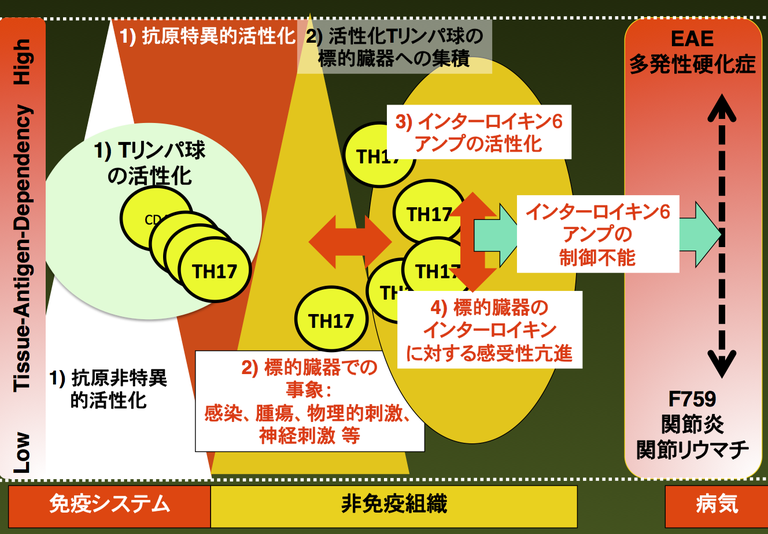
図3: 自己免疫疾患発症の4ステップモデル
1つ目は、Tリンパ球が、つまり免疫系がウイルス感染とかいろいろな原因で活性化される。抗原特異的、抗原非特異的にかかわらず、何らかの原因で活性化すること。2つ目は、活性化Tリンパ球が標的臓器に集積する。たとえば関節リウマチだったら関節に、多発性硬化症だったら脳に、肝炎だったら肝臓に、それが集積する。Tリンパ球の集積には、Tリンパ球による抗原認識以外にも、標的臓器での何らかの事象が役割を果たします。局所に感染が有るとか、関節のように限られた空間とか、ストレスがかかりやすいとか、微小出血が生じやすいとか、あるいは神経刺激などを介する『標的臓器での事象』です。3つ目としてはIL-6アンプの一過性の活性化があります。健康なヒトは、これら3つの条件が生じても病気にはなりません。4つ目は、その時に、標的臓器でのインターロイキンに対する感受性の亢進が非常に重要であるということです。 F759マウスならばStat3の活性化が亢進していることです。他にもIL-6増幅回路に関する種々の分子の活性化が亢進するような遺伝的・環境的要因や慢性感染等も考えられます。これら4つがそろうと、IL-6の増幅回路は慢性的に活性化されて慢性炎症を誘導します。
こういう4つの要因が、関節炎や関節リウマチや多発性硬化症などのさまざまな自己免疫疾患や、炎症性疾患が起こるためには必要です。この4つの要因の寄与の度合いや生じる順番は、病気によってそれぞれ違うと考えられますが、少なくともこういう4つの現象が様々な程度に起り、それらが相互に影響し合うことにより病気が発症すると考えられます。
この標的臓器での事象は神経刺激でも起こることがわかりました。これは最近准教授の村上正晃君らが明らかにした大変興味ある現象です。ネズミで多発性硬化症のモデルを発症させると、重力を感知するヒラメ筋からの感覚神経刺激が交感神経に伝達されて、最終的に第5腰椎の血管内皮細胞に伝わり、そこでIL-6アンプが活性化します。このことは病気の発症に非常に重要で、血液中のTリンパ球がこの場所から脊髄に浸潤していって、最終的に脳炎が起こる。すなわち、神経と免疫が相互作用している。いろいろな神経刺激がいろいろな炎症性疾患を誘導する原因になる、こういうメカニズムが考えられるだろうということが明らかになって来ました。引き続き、痛みや光刺激などが神経系を介して免疫系にどのような効果を与えるのか、そのことが様々な免疫疾患や炎症性疾患の発症や病態にどのような影響を与えるのかと言った疑問に応えるべく研究を続けています。
次に、病気の治療を行なうには、IL-6の増幅回路であるIL-6アンプを人為的にどう制御するかということが重要になります。この問題を解決する為にIL-6アンプ制御に関与している遺伝子を包括的に同定する努力を行ないました。その結果、IL-6アンプを正に制御する1000にも及ぶ多数の遺伝子の存在が明らかになりました。これらの遺伝子群には自己免疫疾患に関与している遺伝子が濃縮されているということがわかりました。自己免疫疾患以外でも動脈硬化等の循環器疾患や神経変性疾患などに関係している遺伝子が凝縮されていました。言い換えると、IL-6アンプは、マウスだけではなく人間のいろいろな炎症性疾患や、自己免疫疾患に関係しているということが明らかになりました。我々が同定したIL-6アンプ制御遺伝子は、今後いろいろな治療薬の開発の標的になるということがわかってきました。
8)夢見て行ない考えて祈る
私はこの40年間、山村先生の言葉であります「夢みて行い考えて祈る」を常に思って研究を行ってきました。私は学生にもいつも言っているのですが、「夢を持ちなさい」と。若い人だけではなくて、60歳になっても80歳になっても夢を持つ……、とにかく死ぬまで「夢みて行い考えて祈る」。山村先生の言葉を胸に今までやってきました。
そして、「目の前の山を登りきる」という大切さを、自ら体験しました。幸い クラフォード賞 や 日本国際賞 を受賞させていただきました。私は研究者として幸せな40年を送って来れたと、あらためて感謝しています。そういう中で、常に山ばかり登っていたわけではありません。谷底に落ちたこともありますし、非常に暗い時期を送ったこともありました。
その中で忘れないのは、ちょうど5年前、還暦のお祝いをしてもらった途端に、人間ドックで胸にあやしい影があるということで2007年9月にCT検査をうけたところ、腫瘍のようなものが見つかりました。確定診断もかねて大阪大学医学部付属病院で手術していただきました。その結果、肺腺がんだったのですが、幸い肺胞内に腫瘍が限局していました。病理学教授に私の病理標本を丁寧に説明していただきました。「これが自分のがん細胞か!」と、妙に納得したことを覚えています。9月19日に左の肺を60%ほど切除したのですが、幸い完治しました。
当時は「一燈を提げて暗夜を行く。暗夜を憂うることなかれ。ただ一燈を頼め—ー言志四録」という心境でした。また、「看護師の一燈の温かさ、医師の一燈の力強さ。我が一燈を信じ、一燈を迷わず、一燈に生きる。我60にして新たな生命を与えられる。これ天命なり」という心境でもありました。私は当時まで本当に研究一筋で生きてきましたが、この経験が私の人生に大きな転換期をもたらしました。
9)大阪大学未来戦略—22世紀に輝く—
還暦後の第2の人生は今までお世話になった大阪大学のために貢献しようと考えるようになりました。未来を担う若い人の育成に貢献しようと考えるようになりました。術後4カ月後の2008年1月に次期医学部長に選ばれ、同年4月から医学部長を3年間務めました。また昨年の2011年8月26日からは、大阪大学の第17代目の総長を務めています。
今、日本は大震災をきっかけにして大変困難な時期を迎えています。しかし、こういう時だからこそ、大学は「学問と教育の府」であるという基本に戻らなければならないと考えています。大学でしかできない基礎研究と優れた人材育成により社会に貢献しなければならないと思います。
適塾 は緖方洪庵を中心に蘭学を日本に導入しました。そして、その適塾に全国から約1,000人の人々が集まったわけです。そこで学んだ人々が全国に散らばって、明治維新を支えたのです。大阪大学はこの適塾を原点にしています。私たちに関わる病気も、天然痘、コレラ、結核から、自己免疫、アレルギー、慢性炎症性疾患、そして癌と変わってきました。その間に大阪大学には、微生物病研究所、細胞工学センターや生命機能研究科などが設立されました。そして2007年には免疫学フロンティア研究センターが開設されました。大阪大学は今年創立81周年を迎え、19年後には100周年を迎えます。今年の新年のあいさつでは、100周年を迎える2031年には大阪大学は世界の10指に入る研究型総合大学になるという夢を語りました。
最近、大阪大学の未来戦略として、[ 大阪大学未来戦略(2012-2015)—22世紀に輝く— ]を策定しました。基本は、『物事の本質を究める学問と教育をする』。これに尽きると思います。そして、山村先生が言われた大阪大学のモットーである「地域に生き世界に伸びる」を心がける必要があります。大阪大学を学問と教育の世界的拠点とするとともに、高い倫理観を保持した優秀なグローバル人材を育成する。そして、知的創造活動としての基礎研究の推進、それに基づいた産学連携・社学連携を推進することです。個々の構成員がはつらつと自由に活動でき、多様性を有するすべての教育研究組織が協力し、かつ独自性を発揮することが大学発展の根本である。こういうことをスローガンに未来戦略8カ条を策定しました。
引き続き学内外に情報発信をしていきますので、大阪大学ホームページ(
www.osaka-u.ac.jp
)にご注目いただきまして、ご支援のほどよろしくお願いいたします。 参考文献
Toshio Hirano, Interleukin 6 in autoimmune and inflammatory diseases: a personal memoir. Proc Jpn Acad Ser B Phys Biol Sci. 2010 July 21; 86(7): 717–730. doi:
10.2183/pjab.86.717
(
PubMed
)